Velocidad de reacción (Trabajo en clase)
Introducción a la cinética:
La cinética de las reacciones químicas es la parte de la química que se encarga del estudio de la rapidez con la que tienen lugar las reacciones (i), uno de los temas más importantes en cualquier proceso químico. Por ejemplo, la energía cinética de una molécula es directamente proporcional a su temperatura, por lo tanto, aumentar la temperatura dará como resultado un aumento en la velocidad de reacción.
mecanismos de reacción:
Un mecanismo de la reacción a la secuencia de pasos intermedios simples que corresponden al avance de la reacción química a escala molecular, mientras que la ecuación química sólo indica los estados inicial y final.
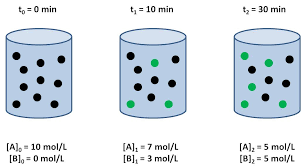
Velocidad de reacción
Ley de velocidad y orden de reacción:
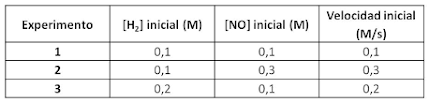
Ley de la velocidad:
Esta ley nos permite calcular la velocidad a la que ocurre reacción y relacionar la velocidad con las concentraciones de los reactivos.
Orden de reacción:
El orden total de una reacción se define como la suma de los exponentes a los que están elevadas las concentraciones de los reactivos en la ecuación de velocidad. En este caso, dicha suma vale 2.
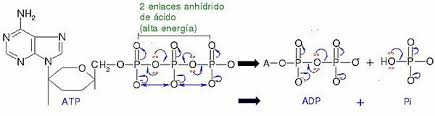
Energía de activación:
Link para ir a Khan Academy
Introducción
La Energía de activación en química y biología es la energía que necesita un sistema antes de poder iniciar un determinado proceso. La energía de activación suele utilizarse para denominar la energía mínima necesaria para que se produzca una reacción química dada. Para que ocurra una reacción entre dos moléculas, éstas deben colisionar en la orientación correcta y poseer una cantidad de energía mínima. A medida que las moléculas se aproximan, sus nubes de electrones se repelen. Esto requiere energía (energía de activación) y proviene del calor del sistema, es decir de la energía traslacional, vibracional, etcétera de cada molécula.



Comentarios
Publicar un comentario